

本講座ではオルガネロパチーをキーワードに、各種オルガネラの機能異常がもたらす神経疾患の病態解明とニューロンの連絡・局所神経回路・シナプス結合およびその可塑性・発生発達などの解析をテーマとして、形態学・細胞生物学・分子生物学の手技を用いて研究を遂行しています。特に、免疫電顕を含む各種超微形態学的解析を重視することが研究室の特徴で、同一細胞組織について光顕から電顕レベルまでシームレスに解析するため各種相関観察法の開発も行なっております。これら解析技術は神経系以外の各種臓器細胞の病態解析においても有用であり、多くの講座、研究室との共同研究も進めて参りました。
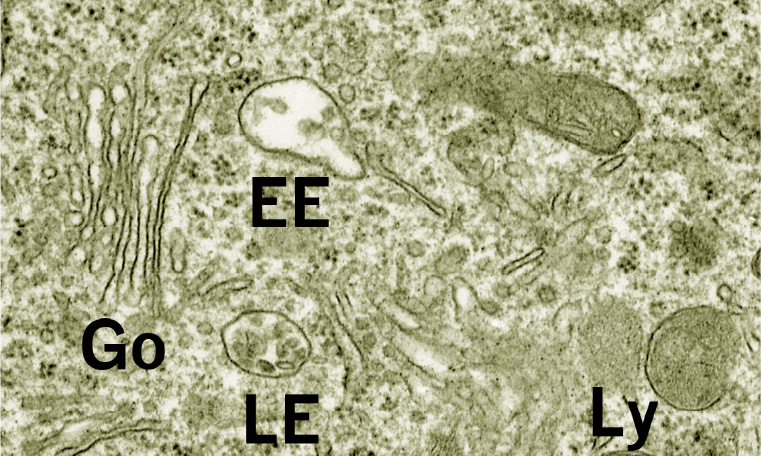
これまで長らく行なってきた、神経変性疾患発症におけるオートファジー・リソソームタンパク分解系の破綻に関する研究を2つの方向に発展させ、「オルガネロパチーと神経変性疾患」という大きなくくりで研究を展開しております。
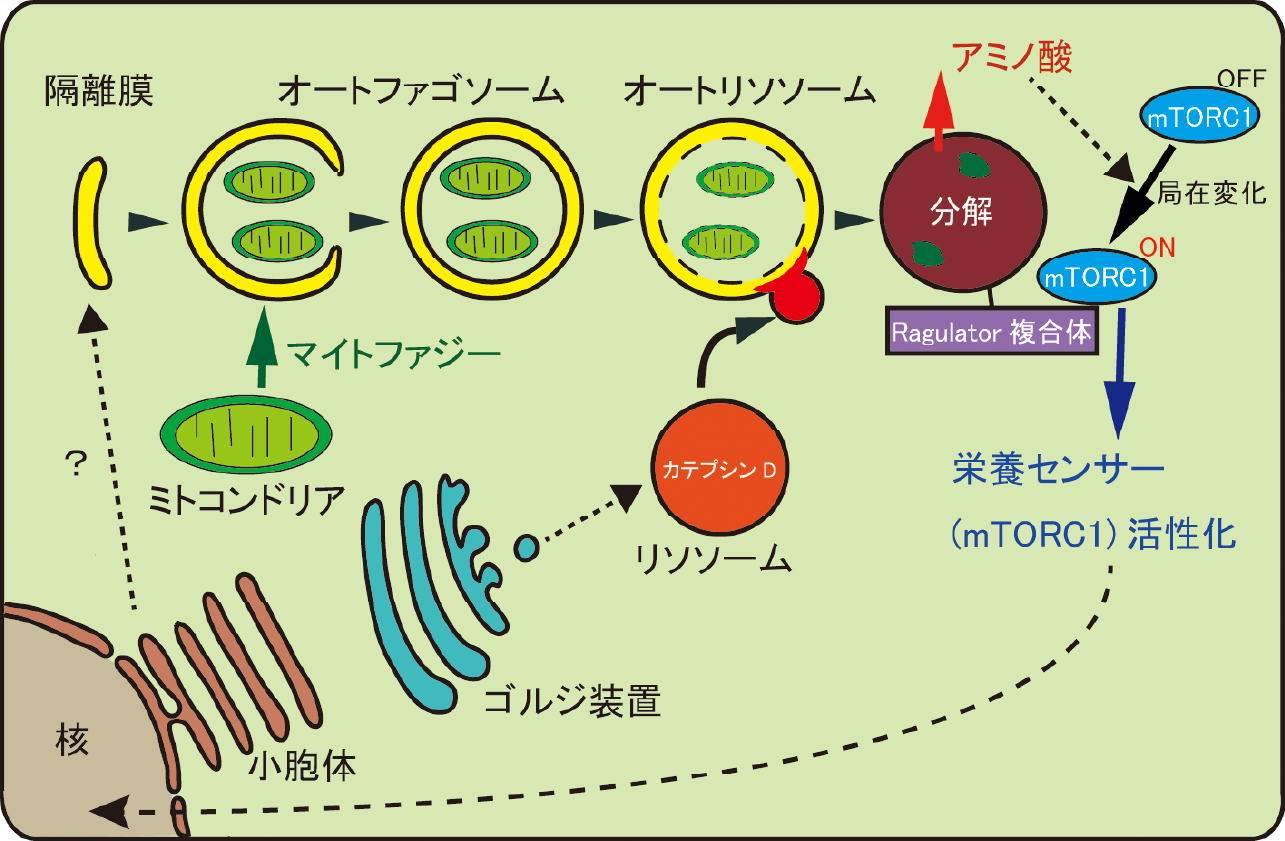
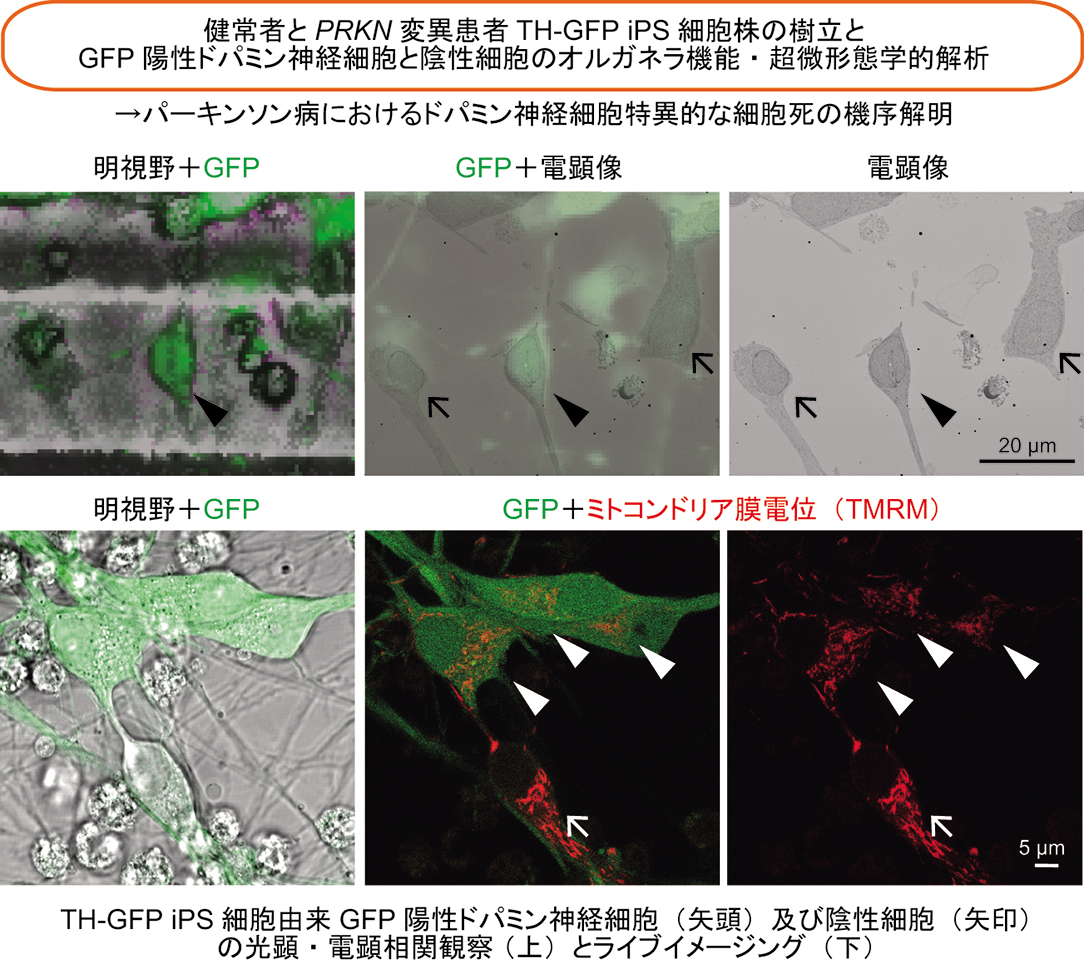
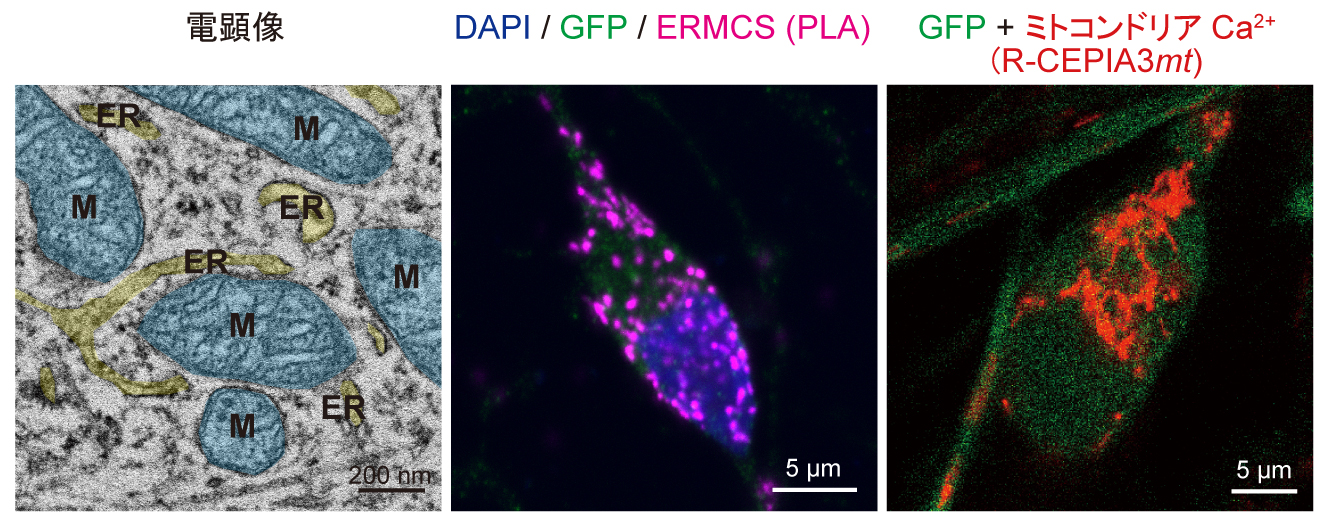
1つ目の方向性は一般的な神経変性疾患であるパーキンソン病の発症メカニズムを希少疾患であるリソソーム病の病態解析を通して明らかにするものです。特にミトコンドリアのオートファジー(マイトファジー)不全をパーキンソン病とリソソーム病で共通して認められる異常の一つとして着目し、マイトファジー不全を呈する患者由来iPS細胞を用いてドパミン細胞特異的な超微形態学的マーカーを明らかにすることを目指しております。そのため、ドパミン神経マーカーであるTyrosine Hydroxylase(TH)遺伝子にGFP遺伝子をノックインしたTH-GFP iPS細胞株を健常者及び遺伝性パーキンソン病患者において作出しました。これらのTH-GFP iPS細胞株を用いた光顕・電顕相関観察やライブイメージングによりドパミン神経細胞特異的なミトコンドリアの形態・機能的特徴を見出しました。さらに、酸化ストレスによるミトコンドリアの形態変化応答に健常者と遺伝性パーキンソン病患者間で差異があることを見出しています(Yokota et al., 2021)。さらに、遺伝性パーキンソン病患者iPS細胞由来ドパミン神経細胞において小胞体ミトコンドリア間接触部位が減少することを形態学的、機能的に明らかにしております(Yokota et al., 2023)。このミトコンドリアの形態変化応答とドパミン神経細胞死との関連解明を目指し、現在も解析を続けています。
2つ目の方向性は、オートファジー・リソソームタンパク分解系異常の関与にとどまらず、他のオルガネラの機能異常との関連や、各種オルガネラ間の相互作用の破綻など、広い意味でのオルガネロパチー (オルガネラ機能の破綻)に着目するものです。その中でも特に不明な点が多い、ゴルジ体の機能破綻と神経変性疾患発症のメカニズムを明らかにすべく、ゴルジ体のマイルドな酸性環境の維持に必須なゴルジ膜タンパク質GPHR(Golgi pH regulator)の中枢神経系における役割についての形態学的解析を行い、小脳プルキンエ細胞特異的GPHR欠損マウスにおいてゴルジの構造機能異常が神経変性のトリガーとなることを明らかにしました(Sou et al., 2019)。さらに、GPHRを⽋損させたマウスの脳では、コレステロール⽣合成関連遺伝⼦群の転写を制御するSREBP2の活性化が抑制されていることが明らかになりました (Sou et al., 2022)。これらの結果はゴルジ体酸性pHが脳内コレステロールの⽣合成に必要であることを示しています。


Yokota, M. *, Yoshino, Y. *, Hosoi, M., Hashimoto, R., Kakuta, S., Shiga, T., Ishikawa K., Okano, H., Hattori, N., Akamatsu W., Koike, M. Reduced ER-mitochondrial contact sites and mitochondrial Ca2+ flux in PRKN-mutated patient tyrosine hydroxylase reporter iPSC lines. Front. Cell Dev. Biol. 11:1171440, 2023. (*These authors contributed equally to this work)
doi: 10.3389/fcell.2023.1171440
Sou, YS., Yamaguchi, J., Kameda, H., Masuda, K., Maeda, Y., Uchiyama, Y., Koike, M. GPHR-mediated acidification of the Golgi lumen is essential for cholesterol biosynthesis in the brain. FEBS letters 596(22):2873-888, 2022.
doi: 10.1002/1873-3468.14491
Yokota, M., Kakuta, S., Shiga, T., Ishikawa, K., Okano, H., Hattori, N., Akamatsu W., Koike, M. Establishment of an in vitro model for analyzing mitochondrial ultrastructure in PRKN-mutated patient iPSC-derived dopaminergic neurons. Mol. Brain 14(1):58, 2021.
doi: 10.1186/s13041-021-00771-0
Sou, YS., Kakuta, S., Kamikubo, Y., Niisato, K., Sakurai, T., Parajuli, LK., Tanida, I., Saito, H., Suzuki, N., Sakimura, K., Maeda, Y., Kinoshita, T., Uchiyama, Y., Koike, M. Cerebellar neurodegeneration and neuronal circuit remodeling in Golgi pH regulator deficient mice. eNeuro 6(3), 2019.
doi: 10.1523/ENEURO.0427-18.2019
Koike, M., Shibata, M., Sunabori, T., Yamaguchi, J., Sakimura, K., Komatsu, M., Tanaka, K., Uchiyama, Y. Purkinje cells are more vulnerable to the specific depletion of cathepsin D than to that of Atg7. Am. J. Pathol. 187(7):1586-600, 2017.
doi: 10.1016/j.ajpath.2017.02.020
Koike, M., Kawahara, A., Shibata, M., Uchiyama, Y. Induction of autophagy in the hippocampus after hypoxic-ischemic injury to neonatal rats. Arch. Histol. Cytol. 77(1):13-23, 2017. 10.1679/aohc.77.13.
doi: 10.1126/science.aaf6136
Sato, S., Koike, M., Funayama, M., Ezaki, J., Fukuda, T., Ueno, T., Uchiyama, Y., Hattori, N. Lysosomal storage of subunit c of mitochondrial ATP synthase in brain-specific ATP13a2-deficient mice. Am. J. Pathol. 186(12):3074-82, 2016.
doi: 10.1016/j.ajpath.2016.08.006
Nanao, T.*, Koike, M.*, Yamaguchi, J., Sasaki, M., Uchiyama, Y. Cellular localization and tissue distribution of endogenous DFCP1 protein. Biomed. Res. 36(2):121-33, 2015. (*These authors contributed equally to this work)
doi: 10.2220/biomedres.36.121
Asano, T.*, Koike, M.*, Sakata, S., Takeda, Y., Nakagawa, T., Hatano, T., Ohashi, S., Funayama, M., Yoshimi, K., Asanuma, M., Toyokuni, S., Mochizuki, S., Uchiyama, Y., Hattori, N., Iwai, K. Possible involvement of iron-induced oxidative insults in neurodegeneration. Neurosci. Lett. 588:29-35, 2015. (*These authors contributed equally to this work)
doi: 10.1016/j.neulet.2014
本学の恵まれた研究施設を活用し、医学・生物学分野の論文発表に直結するpracticalな形態解析技術である光顕、電顕技術のレパートリーをできるだけ増やし、形態像を正しく解釈できる若手の研究者を養成してゆきたいと考えております。その上で、オルガネロパチーに伴う神経回路病変の評価へと研究を発展させるべく、光顕と電顕を繋ぐ技術や各種イメージング技術について以下のような展開を図っております。

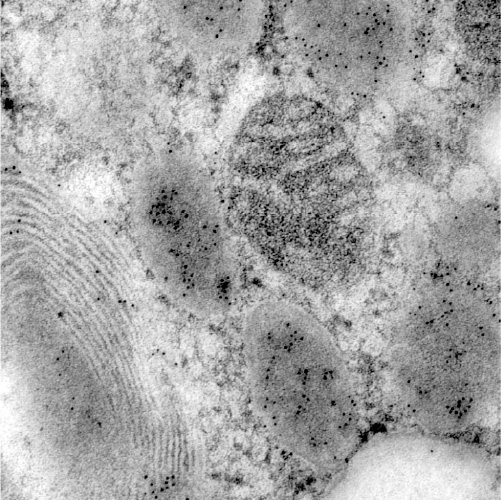
①凍結超薄切片法(徳安法)
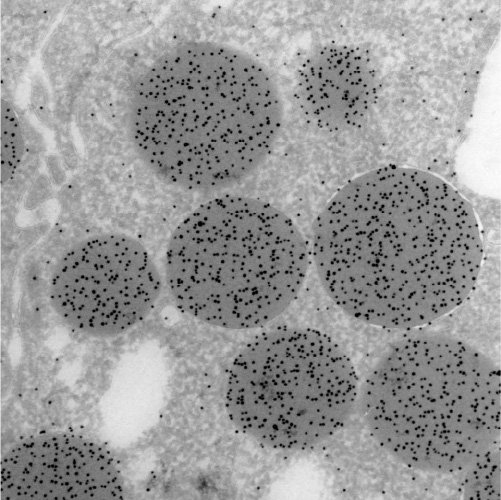
②包埋後免疫電顕法
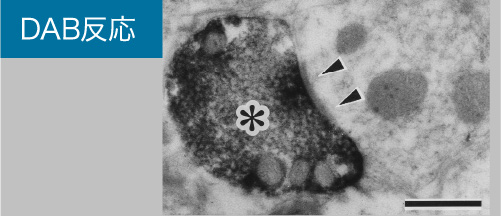
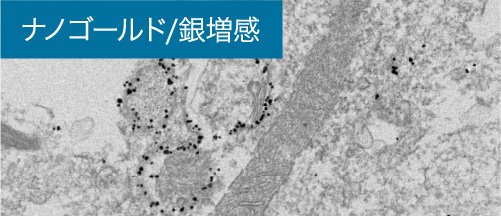
③包埋前免疫電顕法
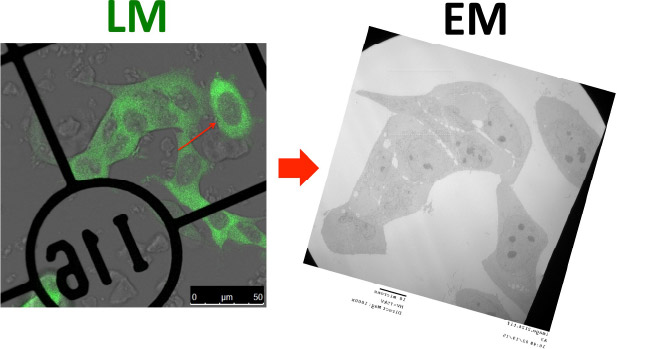
小池が客員教授として2014年6月より3ヶ月滞在したオランダのユトレヒト大学医学部細胞生物学講座/Cell Microscopy Core(Prof. Judith Klumperman)や、当講座客員教授Bruno Humbelがリーダーを務める沖縄科学技術大学院大学(OIST)イメージングセクションとの緊密な連携により、最先端の電顕技術についての情報交換および、凍結超薄切片法を用いたCLEM技術の開発やワークショップの開催を行なっております。


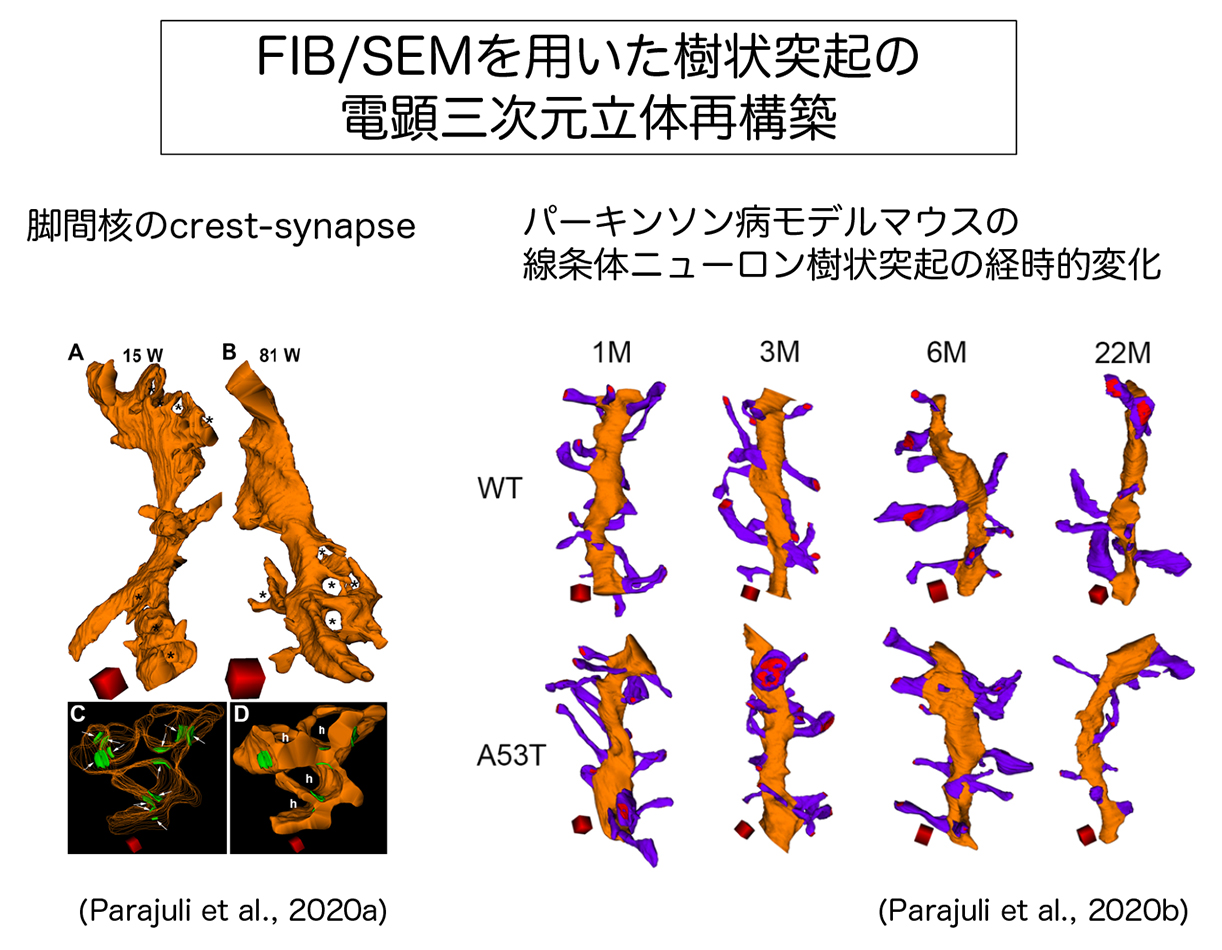
Parajuli, L.K., Koike, M. Three-dimensional structure of dendritic spines revealed by volume electron microscopy techniques. Front. Neuroanat. 5:627368, 2021.
doi: 10.3389/fnana.2021.627368
Parajuli, L.K., Wako, K., Maruo, S,. Kakuta, S., Taguchi, T., Ikuno, M., Yamakado, H., Takahashi, R., Koike, M. Developmental changes in dendritic spine morphology in the striatum and their alteration in an A53T α-synuclein BAC transgenic mouse model of Parkinson's disease. eNeuro 7(4), 2020.
doi: 10.1523/ENEURO.0072-20.2020
Okamoto, S., Sohn, J., Tanaka, T., Takahashi, M., Ishida, Y., Yamauchi, K., Koike, M., Fujiyama, F., Hioki, H. Overlapping projections of neighboring direct and indirect pathway neurons to the external segment of the globus pallidus. iScience 23(9):101409, 2020.
doi: 10.1016/j.isci.2020.101409
Parajuli, LK., Wako, K., Maruo, S., Kakuta, S., Koike, M. Unique synaptic topography of crest-type synapses in the interpeduncular nucleus. Biochem. Biophys. Res. Commun. 530(1):130-5, 2020.
doi: 10.1016/j.bbrc.2020.06.046